一、国务院机构改革组建卫生健康委、市场监管总局和医疗保障局
2018 年 3 月 13 日,国务院机构改革方案提请十三届全国人大一次会议审议,与医药领域密切相关的卫计委、食药总局、医改办被撤销,组建国家卫生健康委员会、国家市场监督管理总局、国家医疗保障局三大部门,原有分工调整合并,推动健康中国战略,促进三医联动,重点关注大健康、人口老龄化、预防重大疾病等方向,为人民群众提供全方位全周期健康服务,医药行业监管开启新的篇章。
二、药品准入进一步专业化监管体系,准入改革仍将进一步持续
组建国家市场监督管理总局,在新总局下面设置单独的国家药品监督管理局,专业化的药监机构将更能体现专业化的监管能力。国家局层面负责药品的审评和审批,省局负责监管药品的生产,大市场基层监管部门负责监管药品的流通。1、药监部门此次机构调整意在专业化监管体系
与市场认知不同,我们认为,此次国家食药监总局归属到大市场监管体系下并不是简单的行政降级,而是从监管的专业性层面保证了药品监管部门的专业性。无论是 2013 年之前归属于卫生部监管的 SFDA 还是 2013 年之后独立出来正部级机构 CFDA,自 2003 年以来,食品药品监管均归属同一部门监管,而在全国层面,食品监管工作的量级和优先级通常高于药品,这也使得原先的食药监部门在监管重心上对食品监管的投入更多。而此次改革则将原先食药监的食品监管部门剥离给大市场部门监管,使得药监局作为单独的行政监管机构在原有的人员编制上能更加聚焦药品的监管。
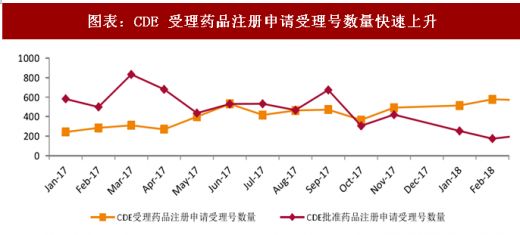
参考观研天下发布《2018年中国医药流通市场分析报告-行业运营态势与发展前景研究》
对于医疗器械而言:医疗器械的准入在以前除了国家药监局,各地的药监局对于产品的准入和管理都有权限,各地的标准不同,导致不同省份的准入难度有别,多重标准使得市场自主调节失效,而权限未来大概率收回国家药监局,地方权限降低或者标准提高,在准入端也使得医疗产品的获批难度加大。这个趋势在过去的三年已经有明确的指向,根据国药监局的批准产品的数量变化,过去三年的准入数量不断下降,我们判断未来将持续此过程。短期来看对于各个公司都有一定的影响,然而却为未来提供了更良好健康的竞争环境。
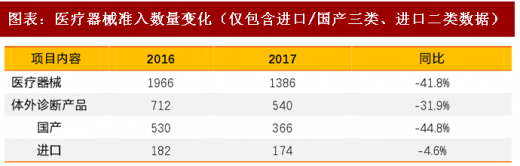
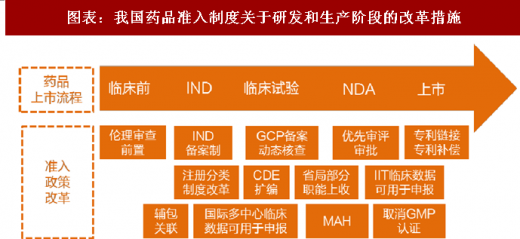
2、药监部门未来垂直化管理保证药政改革顺利推进
同时,市级以下不再设立药品监管部门,将监管相对壁垒较低的药品流通监管纳入大市场监管体系,能够使得药品监管更加聚焦于药品研发和生产领域。我们通过对 2015 年以来药政改革的政策梳理可以发现,截至目前的药政体系改革有望在未来专业化药监机构以及从全国范围推开的药监局国家局-省局的垂直管理体系下发挥更大的作用,从而保证研发以及生产各个层面药政改革政策的顺利推进
3、药品流通阶段的监管以及上市后不良反应的监测未来将面临调整
药监系统的调整将使得整个药品流通环节的监管不再呈现九龙治水的局面,作为药品流通企业以及药店等机构在监管层面在未来仅需要与当地市场监管部门进行协调即可;药品上市后的不良反应监管权限预计将从药监部门为主导转向以卫生部门为主导。
4、新药研发型企业以及产业链相关企业将受益
沿着研发和生产监管专业化的思路,我们认为两类企业有望获益:
1、国内新药研发企业有望获益,在新的监管体系下,药品研发层面无论是从审评审批队伍以及监管核查队伍层面都将面临更为专业化和高效的监管,而生产层面跨区域 MAH 制度的推行也将鼓励质量过硬、符合临床需求的创新药产品尽快上市。从这个角度,相关标的有:恒瑞医药、贝达药业、复星医药、丽珠集团、天士力、华东医药、亿帆医药等
2、优质的研发/生产外包企业将受益于监管环境的改善以及政策的鼓励。一方面,创新药行业整体的爆发也将为 CRO/CMO 企业带来更多的订单,另一方面,新的商业模式包括 MAH、CDMO、产业链延伸也将为医药外包行业带来更多的全新赢利点,提升公司的业绩和整体估值水品。相关标的:泰格医药、药明康德(药明生物)、凯莱英等

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。