参考观研天下发布《2018年中国体外诊断行业分析报告-市场深度调研与发展趋势预测》
1、行业主管部门
(1)体外诊断行业国家食品药品监督管理总局是我国医药行业的主管部门。国家法定用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂按照药品管理,其他体外诊断产品按医疗器械管理。从数量上看,划归医疗器械的品种占到绝大多数。国家药监局下设药品化妆品注册管理司、药品化妆品监管司、医疗器械注册管理司和医疗器械监管司等机构,他们的基本职能包括体外诊断行业的监管、国家和行业标准的发布与实施、产品市场准入、生产企业资格、产品广告宣传、产品临床试验及产品注册审批等。
卫生部主管重大疾病、传染病方面的防治规划和政策措施,对医药行业有直接的影响。中国食品药品检定研究院(原名中国药品生物制品检定所)是国家药监局的直属事业单位,下辖医疗器械检定所和生物制品检定所。医疗器械检定所负责医疗器械注册检验、监督检验、委托检验和进口检验、医疗器械检验检测复验和技术检定等,承担相关医疗器械标准的制订、修订及其实验室验证、医疗器械标准物质研究和标定等;生物制品检定所负责生物制品注册检验、监督检验、委托检验、口岸检验、相关检验检测的复验和技术检定等,承担生物制品新药和进口生物制品的注册检验、质量标准复核、国家标准制订、修订的技术复核与验证、生物制品批签发具体技术及生物制品标准物质研究和标定等。
卫生部临床检验中心是卫生部临床检验质量管理与控制中心,其主要负责全国临床检验的质量管理、技术指导、临床检验仪器的质量评价、参考方法的建立、校准实验室的建立、临床检验专业人员的技术培训等,同时也为卫生主管部门提供临床检验管理方面的咨询意见。2、行业监管体制
(1)归属医疗器械管理的体外诊断试剂的监管体制目前,我国除用于血源筛查的体外诊断试剂,以及采用放射性核素标记的体外诊断试剂归属药品管理外,其它体外诊断试剂和仪器均归属医疗器械管理(国家有明确界定的除外),并且根据风险程度不同,将医疗器械划分为一、二、三类进行管理,对不同类别的生产经营企业采用不同的许可(备案)管理,对不同类别的产品采用不同的产品注册(备案)制度。
①分类管理制度根据《医疗器械监督管理条例》,国家对医疗器械按照风险程度实行分类管理,共分三类。第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
根据《体外诊断试剂注册管理办法》,体外诊断试剂根据产品风险程度的高低,由高至低依次分为第三类、第二类、第一类产品。第三类产品包括与致病性病原体抗原、抗体以及核酸等检测相关的试剂、与血型、组织配型相关的试剂、与人类基因检测相关的试剂、与遗传性疾病相关的试剂、与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂、与治疗药物作用靶点检测相关的试剂、与肿瘤标志物检测相关的试剂、与变态反应(过敏原)相关的试剂等。第二类产品包括用于蛋白质检测的试剂、用于糖类检测的试剂、用于激素检测的试剂、用于酶类检测的试剂、用于酯类检测的试剂、用于维生素检测的试剂、用于无机离子检测的试剂、用于药物及药物代谢物检测的试剂、用于自身抗体检测的试剂、用于微生物鉴别或药敏试验的试剂、用于其他生理、生化或免疫功能指标检测的试剂等。第一类产品包括微生物培养基(不用于微生物鉴别和药敏试验)、样本处理用产品(如溶血剂、稀释液、染色液)等。②生产许可(备案)制度
根据《药品生产监督管理办法》,药品生产企业应当向省、自治区、直辖市人民政府药品监督管理部门申请办理《药品生产许可证》,《药品生产许可证》有效期为 5 年,有效期届满应当重新审查发证。根据《医疗器械监督管理条例》,从事第一类医疗器械生产的,由生产企业向所在地设区的市级人民政府食品药品监督管理部门备案并提交其符合规定条件的证明资料。从事第二类、第三类医疗器械生产的,生产企业应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门申请生产许可并提交其符合规定条件的证明资料以及所生产医疗器械的注册(备案)证。受理生产许可申请的食品药品监督管理部门对申请资料进行审核,按照国务院食品药品监督管理部门制定的医疗器械生产质量管理规范的要求进行核查。对符合规定条件的,准予许可并发给医疗器械生产许可证。医疗器械生产许可证有效期为 5 年。有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。
③经营许可备案制度根据《中华人民共和国药品管理法》,国家对药品经营企业实行许可管理。
《药品经营许可证》有效期为 5 年。 根据《医疗器械监督管理条例》,从事第二类医疗器械经营的,由经营企业向所在地设区的市级人民政府食品药品监督管理部门备案并提交其符合规定条件的证明资料。从事第三类医疗器械经营的,经营企业应当向所在地设区的市级人民政府食品药品监督管理部门申请经营许可并提交其符合规定条件的证明资料。受理经营许可申请的食品药品监督管理部门对符合规定条件的,准予许可并发给医疗器械经营许可证。医疗器械经营许可证有效期为 5 年。有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。④产品生产注册(备案)制度
根据《药品注册管理办法》、《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》,国家对体外诊断产品实行分类注册管理。具体规定如下:
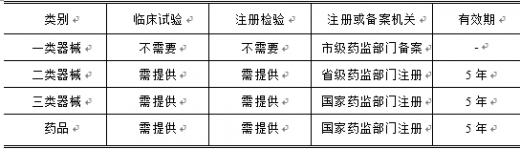
准(技术要求),生产该产品的生产企业必须执行该注册产品标准(技术要求)。
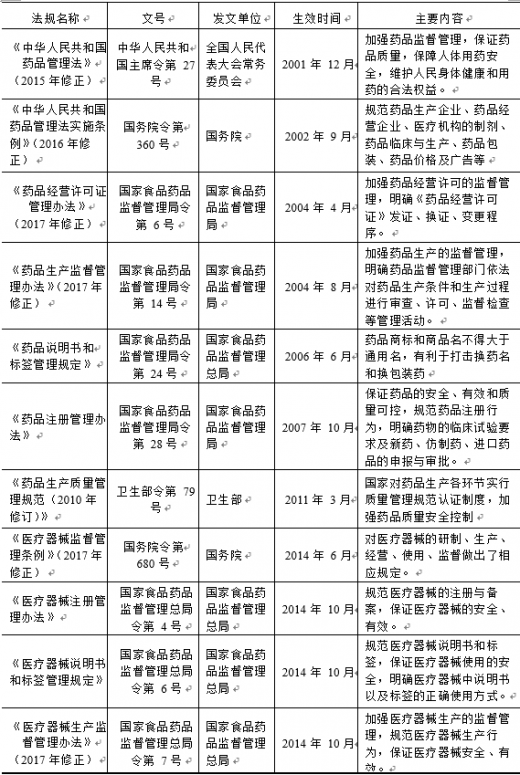
3、 主要法律法规
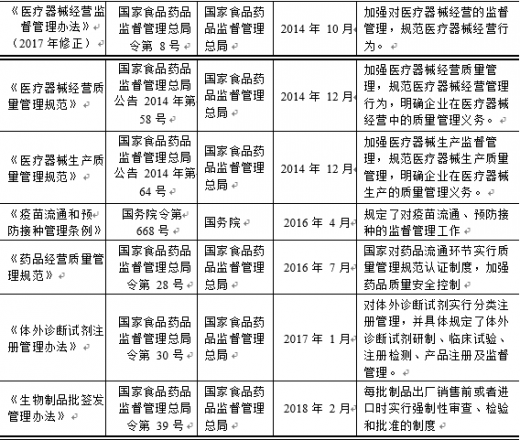
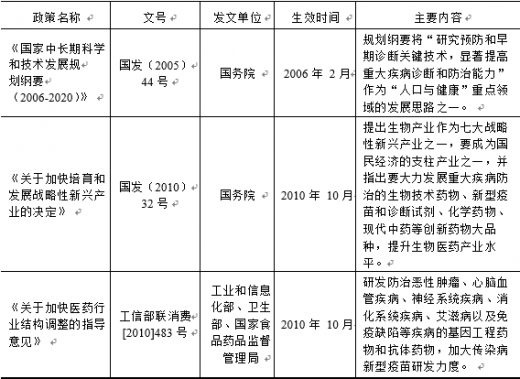
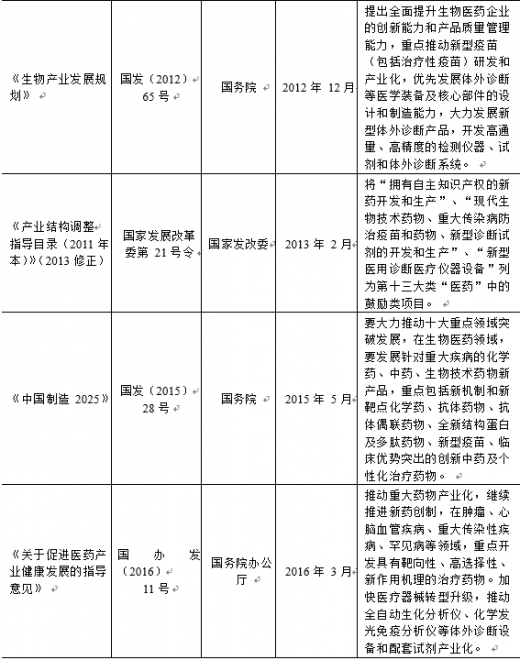
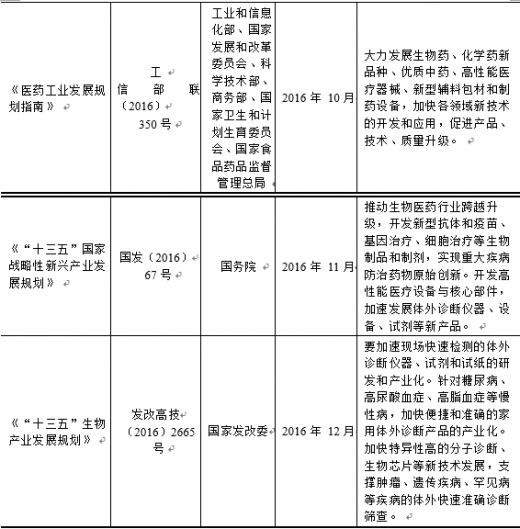

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。