参考中国报告网发布《2017-2022年中国体外诊断市场发展现状及十三五投资策略研究报告》
一、体外诊断行业监管、主要法律法规及政策
1、行业主管部门
体外诊断试剂行业的行政主管部门为国家食品药品监督管理总局,归医疗器械监管司具体管理。国家食品药品监督管理总局医疗器械监管司的主要职责包括:掌握分析医疗器械安全形势、存在问题并提出完善制度机制和改进工作的建议;组织拟订医疗器械生产、经营、使用管理制度并监督实施,组织拟订医疗器械生产、经营、使用质量管理规范并监督实施;拟订医疗器械互联网销售监督管理制度并监督实施;组织开展对医疗器械生产经营企业和使用环节的监督检查,组织开展医疗器械不良事件监测和再评价、监督抽验及安全风险评估,对发现的问题及时采取处理措施;拟订境外医疗器械生产企业检查等管理制度并监督实施;组织开展有关医疗器械产品出口监督管理事项;拟订问题医疗器械召回和处置制度,指导督促地方相关工作;拟订医疗器械监督管理工作规范及技术支撑能力建设要求,督促下级行政机关严格依法实施行政许可、履行监督管理责任,及时发现、纠正违法和不当行为。
2、行业监管制度
目前,我国除用于血源筛查的体外诊断试剂,以及采用放射性核素标记的体外诊断试剂归属药品管理外,其它体外诊断试剂和仪器均归属医疗器械管理(国家有明确界定的除外)。根据风险程度不同,我国对包括体医疗器械实行严格的分类管理政策。在分类管理的基础上,我国医疗器械监管的思路和模式借鉴国际通行方法,对医疗器械的生产经营采取生产许可制度、产品注册与备案制度和经营许可制度,并对医疗器械的使用进行有效监管。
(1)分类管理制度
根据《医疗器械监督管理条例》,国家对医疗器械按照风险程度实行分类管理,共分三类。第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
体外诊断试剂风险程度分类
| 分类 |
主要产品 |
| 第一类 |
包括微生物培养基(不用于微生物鉴别和药敏试验)和样本处理用产品,如溶血剂、稀释液、染色液等。 |
| 第二类 |
包括用于蛋白质检测的试剂,用于糖类检测的试剂,用于激素检测的试剂,用于酶类检测的试剂,用于酯类检测的试剂,用于维生素检测的试剂,用于无机离子检测的试剂,用于药物及药物代谢物检测的试剂,用于自身抗体检测的试剂,用于微生物鉴别或者药敏试验的试剂,用于其他生理、生化或者免疫功能指标检测的试剂。 |
| 第三类 |
包括与致病性病原体抗原、抗体以及核酸等检测相关的试剂,与血型、组织配型相关的试剂,与人类基因检测相关的试剂,与遗传性疾病相关的试剂,与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂,与治疗药物作用靶点检测相关的试剂,与肿瘤标志物检测相关的试剂,与变态反应(过敏原)相关的试剂。 |
《医疗器械生产监督管理办法》规定:开办第一类医疗器械生产企业的,应当向所在地设区的市级食品药品监督管理部门办理第一类医疗器械生产备案。开办第二类、第三类医疗器械生产企业的,应当向所在地省、自治区、直辖市食品药品监督管理部门申请生产许可。对符合规定条件的,准予许可并发给医疗器械生产许可证。医疗器械生产许可证有效期为5 年,有效期届满延续的,应当自有效期届满6 个月前向原发证部门提出延续申请。
(3)产品注册与备案制度
《医疗器械注册管理办法》规定:国家对医疗器械产品实行注册与备案制度。
第一类医疗器械实行备案管理。第二类、第三类医疗器械实行注册管理。境内第一类医疗器械备案,备案人向设区的市级食品药品监督管理部门提交备案资料。
境内第二类医疗器械由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。境内第三类医疗器械由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。《体外诊断试剂注册管理办法》中规定:国家对体外诊断试剂实行注册与备案制度。第一类体外诊断试剂实行备案管理,第二类、第三类体外诊断试剂实行注册管理。境内第一类体外诊断试剂备案,备案人向设区的市级食品药品监督管理部门提交备案资料。境内第二类体外诊断试剂由省、自治区、直辖市食品药品监督管理部门审查,批准后发给医疗器械注册证。境内第三类体外诊断试剂由国家食品药品监督管理总局审查,批准后发给医疗器械注册证。产品注册过程中需要符合相应的产品研制、临床试验、生产企业质量管理体系考核、产品标准及注册检测等要求。经审查符合规定批准注册的产品,由药品监督管理部门核发医疗器械注册证书。医疗器械注册证书有效期为5 年,有效期届满延续的,应当自有效期届满6 个月前向原发证部门提出延续申请。
(4)经营许可制度
《医疗器械经营监督管理办法》规定:按照医疗器械风险程度,医疗器械经营实施分类管理。经营第一类医疗器械不需许可和备案;经营第二类医疗器械实行备案管理,经营企业应当向所在地设区的市级食品药品监督管理部门备案;经营第三类医疗器械实行许可管理,经营企业应当向所在地设区的市级食品药品监督管理部门提出申请。对符合规定条件的,准予许可并发给医疗器械经营许可证。
医疗器械经营许可证有效期为5 年,有效期届满延续的,应当自有效期届满6个月前向原发证部门提出延续申请。
体外诊断试剂分类管理要求
| 类别 |
管理要求 |
监管部门 |
是否需要临床 |
| 一类 |
备案管理 |
市级药监局 |
不需要 |
| 二类 |
注册管理 |
省、自治区、直辖市药监局 |
需要 |
| 三类 |
注册管理 |
国家药监总局 |
需要 |
3、行业主要法律法规和政策
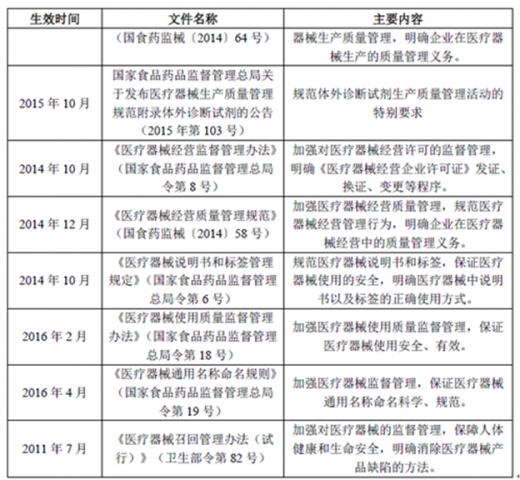
(1)主要法律法规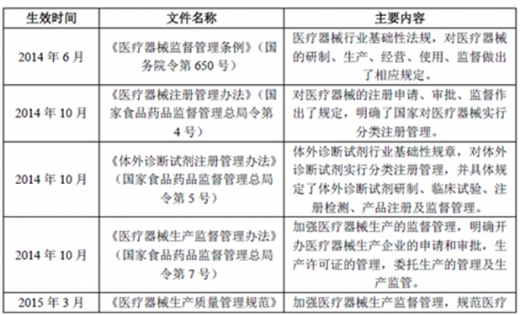
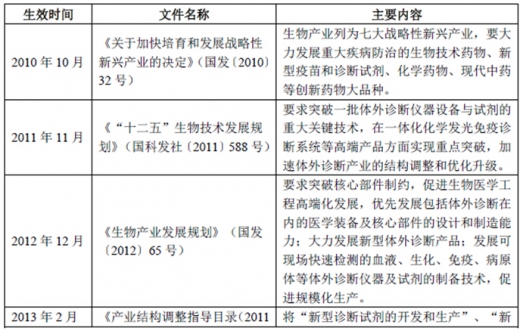
(2)国家产业发展相关政策
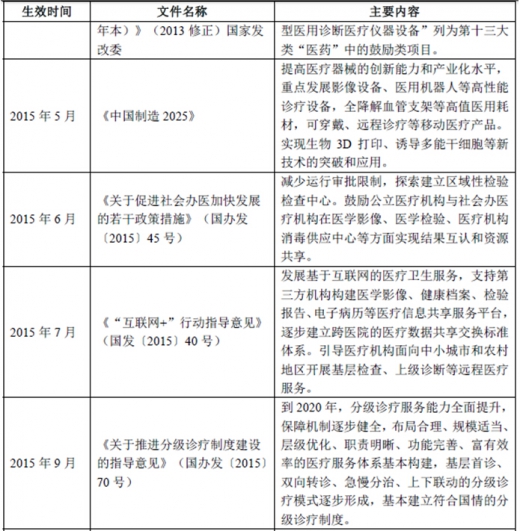
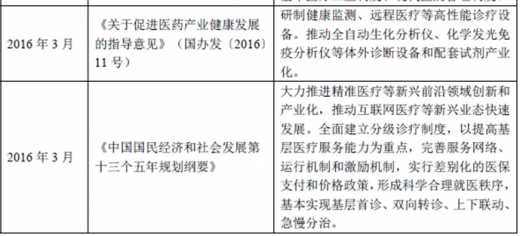
二、体外诊断行业竞争情况
1、全球市场竞争情况
经过多年发展,全球体外诊断已成为拥有数百亿美元庞大市场容量的朝阳行业,产业发展成熟,市场集中度较高,形成了一批著名跨国企业集团,主要代表企业有瑞士Roche(罗氏)、美国Abbott(雅培)、美国Alere(美艾利尔)、丹麦Radiometer(雷度米特)等。
(1)瑞士Roche(罗氏)
成立于1896 年,总部位于瑞士巴塞尔。Roche 是体外诊断和基于组织的肿瘤诊断的市场领导者,也是糖尿病管理领域的先驱者。2014年,罗氏全球员工总数超过88,500 名,研发投资逾89 亿瑞士法郎,销售额达475亿瑞士法郎。
罗氏生物主要经济指标分析
| 经济指标 |
2016年(单位:百万瑞郎) |
| 流动资产合计 |
28670.00 |
| 资产总计 |
76819.00 |
| 长期负债合计 |
16992.00 |
| 主营业务收入 |
25554.00 |
| 净利润 |
4198.00 |
(2)美国Abbott(雅培)
成立于1888 年,总部位于美国芝加哥。Abbott 业务涵盖医药的研究、生产、销售以及疾病的预防、诊断和治疗。致力于糖尿病、各种疼痛、呼吸道感染、HIV、男女健康、妇幼保健、兽病等方面的研究,在医药、营养学和医疗器械生产的领域中占据领导地位。
雅培主要经济指标分析
| 经济指标 |
2016年(单位:百万美元) |
| 流动资产合计 |
19329.00 |
| 资产总计 |
70887.00 |
| 长期负债合计 |
23764.00 |
| 主营业务收入 |
6335.00 |
| 净利润 |
419.00 |
(3)美国Alere(美艾利尔)
成立于1975 年,总部位于美国波士顿。Alere 公司是全球领先的健康诊断产品和健康诊断管理方案的提供者,拥有2 万名左右的员工以及超过800 人的研发团队,在全球拥有超过50 家的分支机构。Alere 公司产品集中在心血管、妇女健康、传染性疾病、药物滥用、肿瘤等5 大领域。
美国Alere主要经济指标分析
| 经济指标 |
2016年(单位:百万美元) |
| 流动资产合计 |
1459.90 |
| 资产总计 |
5648.28 |
| 长期负债合计 |
2865.43 |
| 主营业务收入 |
596.81 |
| 净利润 |
-116.90 |
(4)丹麦Radiometer(雷度米特)
成立于1935 年,总部位于丹麦哥本哈根,是全球领先的危急症解决方案提供商。在全球拥有超过2700名员工,并在30个国家直接设有分公司。雷度米特帮助医疗专业人士快速准确地获得危急症检测最重要的参数信息,包括氧气,乳酸和肌钙蛋白。雷度米特开发、生产以及销售危急症检测全面解决方案,涵盖血液采样,血气分析,经皮监测,免疫检测以及相关IT管理系统等。
体外诊断行业全球市场格局
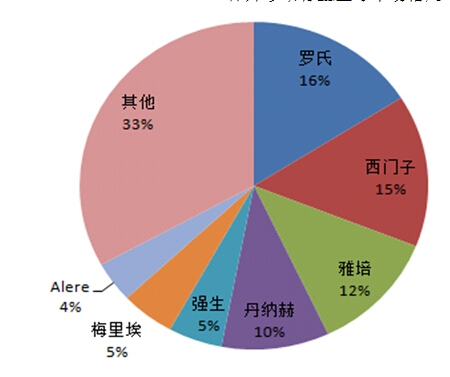
资料来源:观研天下数据中心整理
2、国内市场竞争情况
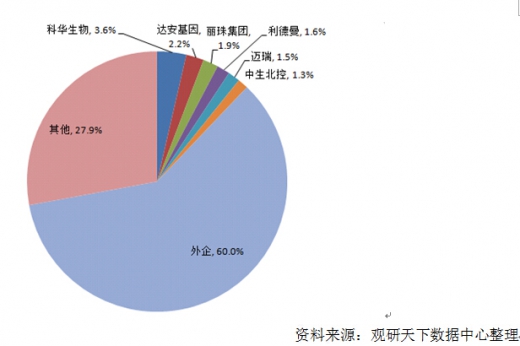
我国体外诊断产业仍处于成长期,国内行业集中度较低,主要为试剂厂商,且大部分为中小企业,产品品种少,厂家数量多。目前国内主要的POCT 生产厂家主要有万孚生物、基蛋生物、瑞莱生物等。
(1)万孚生物
成立于1992 年,总部位于广州,注册资金6,600 万元。万孚生物致力于生物医药体外诊断行业中快速检测POCT 产品的研发、生产和销售,在毒品(滥用药物)检测、传染病检测、妊娠及优生优育检测领域具有较强的优势。2014 年,万孚生物拥有员工937 人,销售额达3.65 亿元人民币。
万孚生物主要经济指标分析
| 经济指标 |
2016年 |
| 流动资产合计 |
726,201,000.00元 |
| 资产总计 |
1,005,750,000.00元 |
| 长期负债合计 |
10,720,500.00元 |
| 主营业务收入 |
547,353,000.00元 |
| 净利润 |
144,987,000.00元 |
(2)基蛋生物
成立于2002 年,总部位于南京,注册资金9,900 万元。基蛋生物专业从事体外诊断试剂和医疗器械的研发、生产、销售,在心血管类、炎症类疾病监测领域具有较强的优势。2014 年,基蛋生物拥有员工818 人,销售额达2.10 亿元人民币。2016年成为南京医疗器械管理协会副会长单位、南京市IVD协会会长单位,南京体外诊断试剂分会会长单位,行业地位显著(3)瑞莱生物
成立于2001 年,注册地为深圳,注册资金519 万美元,投资总额800 多万美元,是美国ReLIA 生物科技公司在中国的独资企业。瑞莱生物主要从事高新生物技术产品的研发及产业化生产,公司自主开发了ReLIA 检验系统,在国内率先建立拥有多项国际自主知识产权的POCT 技术体系。
体外诊断行业国内市场格局

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。