1 创新药全产业链迎来制度性利好
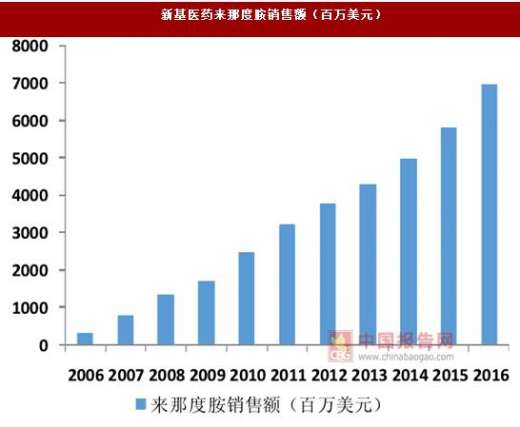
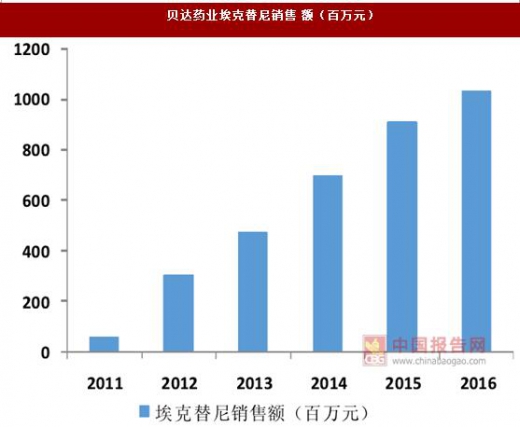
创新药无疑是医药行业之中最具有吸引力的细分领域,由于其往往针对于未满足的临床需求,因此具有较高的临床价值,市场空间较大,也属于刚需品种,具有较强的议价能力;再加上创新药均拥有一定的专利保护期,在此期间不受仿制药的冲击,可以在一段时间内保持高定价,因此创新药具备成为重磅品种的潜力。以新基医药的来那度胺为例,该药品于 2005 年上市,经历了多次的适应症拓展后,在 10 年时间内成长为年销售额近 70 亿美元的大品种。在国内,贝达药业研发的治疗EGFR突变型非小细胞肺癌药物埃克替尼在短短6年内其年销售额也超过了 10 亿元。目前我国医药工业正在从以仿制药为主到仿创结合的升级时期,行业内已经一定资本积累的龙头企业正在积极开展创新药的研发,创新药将成为驱动医药工业成长的新引擎。
今年以来,CFDA 发布了多项涉及创新药的的文件和征求意见稿。涉及进口注册、临床试验申请和临床试验数据等诸多方面,人社部也正在进行新一轮的医保药品谈判,并开始征求医保目录动态调整机制的意见,连同始于 2016 年的优先审评政策。我们认为,创新药整个产业链从研发、审评到最终的医保支付正在经历深度变革,各类政策必将深刻地影响到整个产业发展的趋势。

2 审评提速,创新药研发效率提升
在CFDA发布的《关于调整进口药品注册管理有关事项的决定(征求意见稿)》中提出:在中国进行国际多中心药物临床试验的,取消临床试验用药物应当已在境外注册或者已进入 II 期或者 III 期临床试验的要求,完成国际多中心药物临床试验后,可以直接提出药品上市注册申请。
《关于鼓励药品医疗器械创新改革临床试验管理的相关政策(征求意见稿)意见》中提出:允许境外企业和科研机构在中国开展药物Ⅰ期临床试验。我们认为,该项政策拉平了国外创新药在全球各个地区临床试验的进度。
可以实现创新药的全球同步研发,创新药在国内有望第一时间上市,最大的受益者国外药企的创新药, 之前国内企业在进行创新药研发时可以采用快速跟随策略( Fast Follow-on),针对已知靶点和分子结构,创制 me-too 药物,这样可以确保研究的成功率,同时由于国外同类创新药在国内外上市存在着时间差,在国内上市时间较晚,国产创新药可以借此缩小与国外创新药在国内上市时间上的间隔,尽可能多得抢占市场份额。
但新规出台后,国外创新药可以在第一时间进入国内,me-too药物在上市时需要与 first in-class 药品进行头对头临床研究,在临床疗效上至少要达到非劣效性才有可能获批上市,并获得医学界认可,从而打开市场空间。
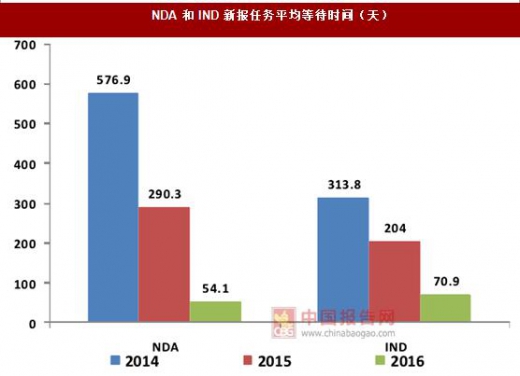
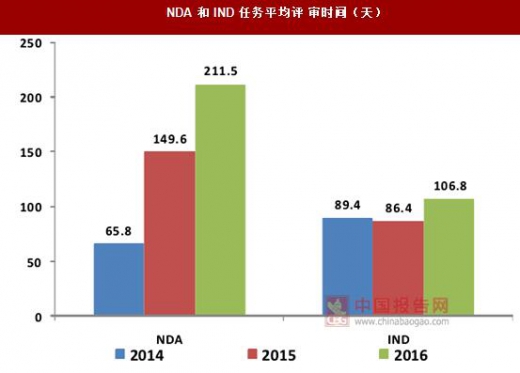
因此原有的“微创新”策略已经不能适应当下的市场和政策环境,新药的研发应当瞄准未满足的临床需求,这样才能在创新药市场中占据一席之地,对国内企业的创新药研发水平提出了更高的要求。 目前我国新药临床试验的审评仍需要花费大量的时间,2016年,新药临床试验申请(IND)在审评前的平均等待时间约为71天,审评平均则需花费107天,合计近180天时间。
新规出台后,临床试验申请自审评机构受理之日起60个工作日后,没有给出否定或质疑的审查意见即视为同意,申请人可按照递交的方案开展临床试验,此举与现行国际惯例相接轨,彻底解决了新药临床申请审评和等待时间过长的问题,创新药审评程序得到了简化,速度大大提高,研发活动将更加高效。
对于临床数据,本次新规提出申请人在境外取得的临床试验数据,符合中国药品医疗器械注册相关要求的,经现场检查后可用于在中国申报注册申请。境外企业在中国进行的国际多中心药物临床试验,符合中国药品注册相关要求的,完成国际多中心临床试验后可以直接提出上市申请。
我们认为,首先受益的是境外企业,认可境外临床数据意味着可以免除在国内重新进行临床试验,加快创新药在国外上市的步伐。其次,国内企业可以引进海外较为成熟(推进到临床 II-III 期),研发成功概率较高的新药项目,获取其在国内市场的销售权。这些项目可以在国内开展多中心临床试验或在境外开展临床试验,由于项目本身已经较为成熟,在国内成功上市的概率也较大,拥有海外成熟新药项目的企业值得关注。
3 医保目录动态调整机制逐步完善,创新药医保支付难题有望得到解决
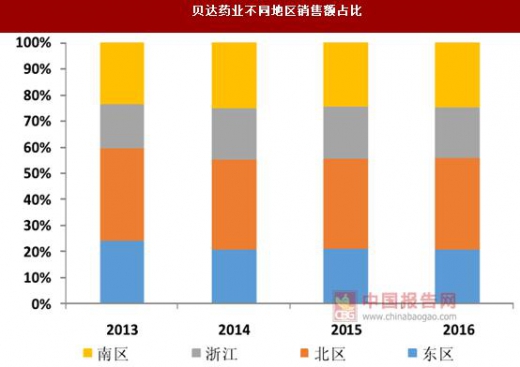
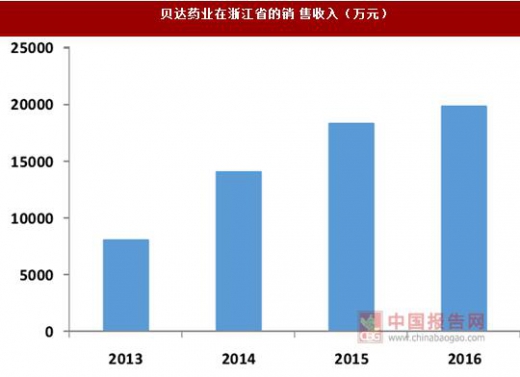
创新药由于研发成本较高,因此往往采用高定价的策略,对于患者而言经济负担较重,特别是治疗诸多肿瘤等重大疾病的创新药,因此能否及时进入医保,对于药品销售量的提升至关重要。以埃克替尼为例,在 2016 年之前,该产品仅进入了浙江省基本医疗保险和其他一些地区的新农合或城镇医保,从公司收入的地区分布来看,仅浙江一省的销售收入就占到全部收入的近 20%。
埃克替尼于2013 年 2 月进入了浙江省医保,在政策逐渐落地之后,2014 年该产品在浙江的销售增速为 75%,而公司当年整体收入增速为 47%,远超过平均水平。由此我们可以看出,进入医保目录后由于医保基金能够承担一部分费用,减轻了患者的经济负担,创新药的销售额往往能迎来一个大幅提升。
近期关于创新药的系列政策也涉及到了创新药医保支付的问题。作为医保基金的主管部门,人社部在 2 月份发布了新版医保目录,将近年来上市的多个具有较高临床价值的国产创新药如恒瑞医药的艾瑞昔布、贝达药业的埃克替尼、三生制药的益赛普等纳入新版医保目录。
另一方面,我们认为更应当关注医保目录动态调整长效机制的建立。目前人社部已经将 44 个药品纳入谈判范围,其中也包括了近年来上市但未能进入新版医保目录的国产创新药,同时人社部也开始征求完善医保目录调整的意见。
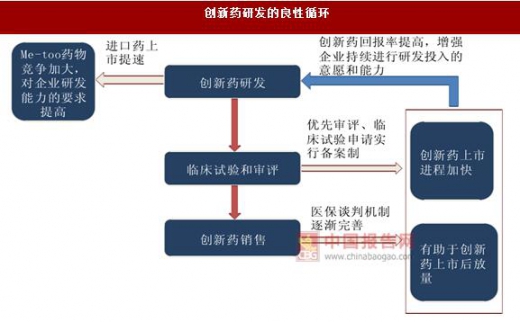
随着医保目录动态调整机制的建立与完善,创新药从上市到纳入医保的时间将大为缩短,有助于创新药在上市后尽早放量,提高创新药的回报率。企业也有动力和资金继续进行创新药的研发, 构成创新药研发的良性循环。
在创新药领域,由于政策和市场环境对于企业的研发水平提出了更高的要求,我们建议关注创新药龙头企业恒瑞医药,此外拥有海外成熟创新药项目的企业也可以积极关注,如贝达药业(拥有 X-396 中国地区权益,国内获批多中心临床)。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。