一、三大法案从不同角度解放准入束缚,创新药行业逐步摆脱准入瓶颈
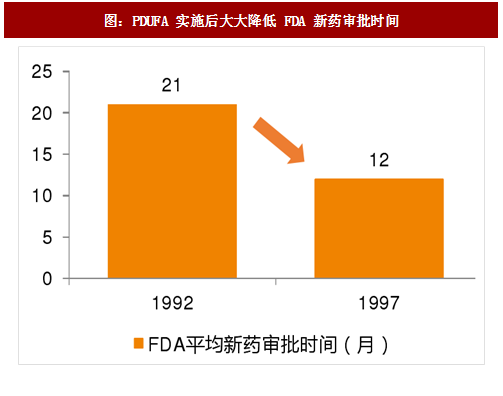
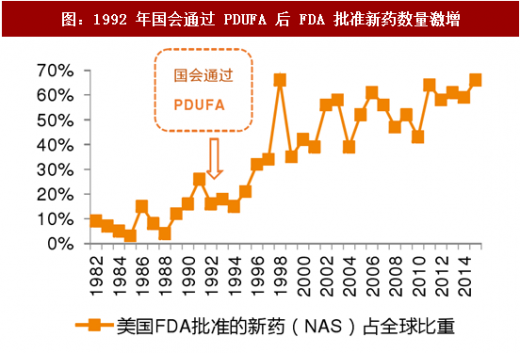
《处方药申报者付费法案(PDUFA)》的出台极大的提升了 FDA 工作效率上世纪 80 年代之开始,美国新药申报数量逐年增多,新药申报技术要求不断提高,需要药企递交的申报资料也越来越多,这一方面增加了 FDA 工作量,另一方面导致了新药审批时间的不断延长,在此背景下,1992 年美国国会通过了《处方药申报者付费法案(PDUFA)》,并规定了 5 年的执行期(Sunset 条款),在 1992-1997 年的 5 年间,FDA 在没有降低审评标准和增加政府财政拨款的前提下,处理了堆积如山的药品申请,探索了新的审批机制,设立了药品审查过程中的各个工作期限,圆满的完成了 PDUFA I 所设立的目标,在此基础上,PDUFA 顺利推进到下一个 5 年,截至今日,PDUFA 已获得国会第六次授权(PDUFA VI);同时美国国会借鉴 PDUFA,对医疗器械(MDUFA)、仿制药(GDUFA)、生物仿制(BsUFA)药分别设立了相应的申请人付费法案,极大程度提升了 FDA 在医药工业各个领域的监管能力和工作效率,改善了美国医药行业准入端的瓶颈。
参考观研天下发布《2017-2022年中国医药行业市场发展现状及未来前景分析报告》
Hatch-Waxman 法案和拜度法案从知识产权角度给予新药研发极大支持如果说 PDUFA 法案是从监管角度改善新药上市瓶颈,那么拜杜法案和 Hatch-Waxman 法案则是从知识产权、专利保护和药品竞争的角度给予产业界做新药研发的动力。拜杜法案从早期的知识产权角度给予了明晰的归属,明确了发明人对专利享有收益权,这从根本上解决了科研成果转化的激励机制问题;而众所周知的 Hatch-Waxman 法案不仅从鼓励专利到期后仿制药的上市,通过降价节约卫生费用支出的角度给予了美国医药产业更持久的发展动力,更从给予专利药在审评中时间损耗给予专利补偿期、试验数据保护的角度鼓励制药企业的新药研发。因此说,Hatch-Waxman 法案、拜度法案与 PDUFA 组成了美国新药研发领域蓬勃发展的制度基石,它们使得美国新药研发逐步步上高速发展的轨道。

二、完善的保险体系和市场化定价机制是新药研发产品支付的保证
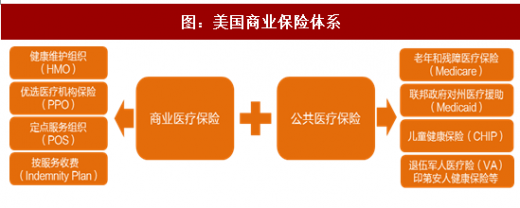
美国不仅有全球最大和最高效的药品监管机构 FDA,还有全球最为市场化、层次结构最为丰富的医疗保险体系。公共医疗保险主要包括:对 65 岁以上的老人或者 65 岁一下残疾人或者晚期肾病患者的 Medicare 以及在此基础衍生出来的商业补充保险 Medigap;针对低收入的孕妇、未满 19 岁的青少年、65 岁以上的退休人士等的免费医疗服务 Medicaid,针对 19 岁以下儿童的 CHIP 以及针对特殊人群如退伍军人、印第安人的健康保险等。商业保险方面,美国拥有世界上最为丰富的商业健康险种类,由于美国健康保险监管立法权在隔周,美国健康保险市场集中程度较低,保险公司间高度竞争;在保险形式上,主要有:优选医疗机构保险(PPO,34%),健康维护组织(HMO,31%),定点服务组织(POS)和按服务收费(Indemnity Plan)等类型。
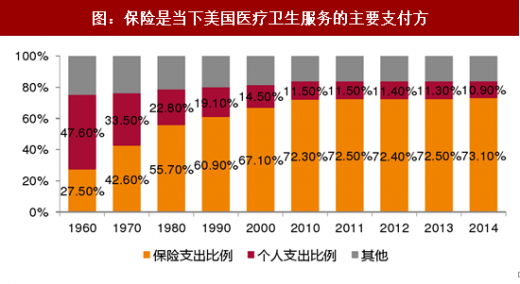
美国医疗保险支付体系的不断完善为美国的新药研发的终端支付提供了保证。数据显示,从1960年到2014年,美国保险支出占整个医疗卫生服务费用的比例逐年提升,而Medigap 商业补充医疗保险以及形式各异的商业医疗保险则更多的覆盖了高价值的新药,支付能力的保证也使得美国药品创新有了更多利益上的保证。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。






