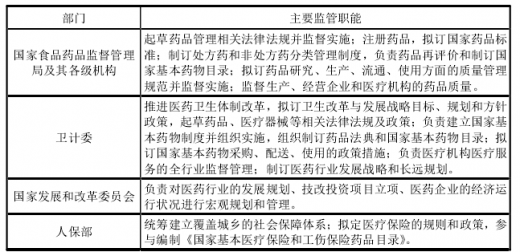
我国医药行业主要由4个部门负责监督管理,其中,国家药监局及其各级机构为医药行业主管部门。各部门涉及医药行业主要监管职能如下:
2、医药行业监管体制
(1)药品生产许可证制度
在我国开办药品生产企业,须经企业所在地省、自治区、直辖市人民政府药品监督管理部门批准并授予《药品生产许可证》,凭《药品生产许可证》到工商行政管理部门办理登记注册。国家食品药品监督管理部门对新药临床试验审批通过后,新药方可进行临床试验;对完成临床试验并通过新药生产审批的单位,下发《药品注册批件》和新药证书;对已持有《药品生产许可证》并具备该药品相应生产条件的,同时发给药品批准文号。药品生产企业在取得药品批准文号并通过GMP 认证后,方可生产该药品。
(2)药品生产质量管理规范(GMP)制度
药品生产企业必须按照国务院药品监督管理部门制定的《药品生产质量管理规范》组织生产。药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证;对认证合格的,发给认证证书。
2011年2月,卫生部发布《药品生产质量管理规范(2010年修订)》(简称“新版GMP”)。新版GMP对药品生产企业的全面质量管理体系建设、从业人员素质、操作规程、药品安全保障、质量风险控制等方面进行了更为严格和细化的规定,对药品生产企业的生产设施及生产环境等提出了更为严格的要求。新版GMP于2011年3月1日开始施行。自2011年3月1日起,新建药品生产企业、药品生产企业新建(改、扩建)车间应符合新版GMP的要求。现有药品生产企业给予不超过5年的过渡期,并依据产品风险程度,按类别分阶段达到新版药品GMP的要求。
(3)新药证书和药品批准文号制度
研制新药必须按照国务院药品监督管理部门的规定如实报送研制方法、质量指标、药理及毒理试验结果等有关资料和样品,经国务院药品监督管理部门批准后,方可进行临床试验。完成临床试验并通过审批的新药,由国务院药品监督管理部门批准,发给新药证书。
药品批准文号是指药品生产企业在生产药品前报请国家药品监督管理部门批准后获得的身份证明,是依法生产药品的合法标志。生产新药或者已有国家标准的药品,须经国务院药品监督管理部门批准,并发给药品批准文号。药品生产企业在取得药品批准文号并通过GMP 认证后,方可生产该药品。
(4)药品注册管理
根据新的《药品注册管理办法》(国家药监局令第28号),药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。
新药申请是指未曾在中国境内上市销售的药品的注册申请。对已上市药品改变剂型、改变给药途径、增加新适应症的药品注册,按照新药申请的程序申报。
企业研究并申请新药须经过药物临床前研究、临床研究及新药生产申报等阶段。
参考观研天下发布《2018-2023年中国医药行业市场现状规模分析与投资价值前景评估报告》
其中,临床试验分为I、II、III、IV期,新药在批准上市前应当根据新药注册类别进行相应的临床试验。仿制药申请,是指生产国家药品食品监督管理局已批准上市的已有国家标准的药品提出注册申请。
再注册申请,是指药品批准证明文件有效期满后申请人拟继续生产或者进口该药品而提出的注册申请。国家药监局核发的药品批准文号、《进口药品注册证》或《医药产品注册证》的有效期为5年。有效期届满,需要继续生产或者进口的,申请人应当在有效期届满前6个月向所在地省、自治区、直辖市药品监督管理部门申请再注册。凡已正式受理的再注册申请,其药品批准文号在再注册审查期间可以继续使用。
(5)国家药品标准制度
国家药品标准是指国家为保证药品质量所制定的质量指标、检验方法以及生产工艺等技术要求,包括SFDA颁布的《中华人民共和国药典》、药品注册标准和其他药品标准。
(6)处方药和非处方药分类管理制度
我国实行处方药和非处方药分类管理制度。处方药和非处方药分类管理,是国际通行的药品管理模式。通过加强对处方药和非处方药的监督管理,规范药品生产、经营行为,引导公众科学合理用药,减少药物滥用和药品不良反应的发生、保护公众用药安全。
(7)化学药品注射剂基本技术要求
国家药监局发布《关于发布化学药品注射剂和多组分生化药注射剂基本技术要求的通知》国食药监注[2008]7号文件,制定了化学药品注射剂基本技术要求。
该技术要求主要针对目前化学药品注射剂研发、生产和使用中存在的突出问题,在遵循一般评价原则的基础上,通过分析可能影响注射剂临床使用安全性的主要因素,结合品种的上市基础等,提出化学药品注射剂审评中的关注重点和相应的技术要求。该要求对化学药品注射剂选择的合理性、科学性,使用的合理性,生产工艺控制,原材料的选择标准等事项进行了明确规定。
(8)药品包装的管理制度
根据《中华人民共和国药品管理法》、《药品注册管理办法》、《直接接触药品的包装材料和容器管理办法》及《直接接触药品的包装材料和容器标准汇编》等文件的要求:直接接触药品的包装材料和容器,必须符合药用要求,符合保障人体健康、安全的标准,在进行多项研究之后由药品监督管理部门进行审批;使用新种类包材的药品需要进行多项研究测试后,根据要求进行申报。药品生产企业不得使用未经批准的直接接触药品的包装材料和容器。药品包装必须符合药品质量要求,并保证不会发生药物失效及与药物产生化学反应等问题,同时方便储存、运输和医疗使用。
3、医药行业主要政策法规和发展规划
(1)《关于深化医药卫生体制改革的意见》
2009年3月17日,国务院发布《中共中央国务院关于深化医药卫生体制改革的意见》,正式启动新一轮医改,深化医药卫生体制改革主要内容有:建立健全覆盖城乡居民的基本医疗卫生制度,为群众提供安全、有效、方便、价廉的医疗卫生服务。到2011年,基本医疗保障制度全面覆盖城乡居民,基本药物制度初步建立,城乡基层医疗卫生服务体系进一步健全,基本公共卫生服务得到普及,公立医院改革试点取得突破,明显提高基本医疗卫生服务可及性,有效减轻居民就医费用负担,切实缓解“看病难、看病贵”问题。到2020年,覆盖城乡居民的基本医疗卫生制度基本建立。
(2)《关于建立国家基本药物制度的实施意见》等三份文件
2009年8月18日,为贯彻落实中共中央、国务院深化医药卫生体制改革的文件精神,国务院深化医药卫生体制改革领导小组发布了《关于建立国家基本药物制度的实施意见》、《国家基本药物目录管理办法》(暂行)》和《国家基本药物目录(基层医疗卫生机构配备使用部分)》(2009版)。
(3)《医药工业“十二五”规划》
2012年1月19日,工业和信息化部发布《医药工业“十二五”发展规划》,以加快医药工业结构调整和转型升级,培育发展生物医药产业,促进医药工业由大变强。《规划》指出,“十二五”期间医药工业发展的主要任务为:一是增强新药创制能力;二是提升药品质量安全水平;三是提高基本药物生产供应保障能力;四是加强企业技术改造;五是调整优化组织结构;六是优化产业区域布局;七是加快国际化步伐;八是推进医药工业绿色发展;九是提高医药工业信息化水平;十是加强医药储备和应急体系建设。《规划》同时指出,“十二五”期间应抓住国内外医药需求快速增长和全球市场结构调整的重大机遇,落实培育和发展战略性新兴产业的总体要求,大力发展生物技术药物、化学药新品种、现代中药、先进医疗器械、新型药用辅料包装材料和制药设备。
(4)《关于进一步加强抗菌药物临床应用管理工作的通知》
2015年7月24日,国家卫计委下发《关于进一步加强抗菌药物临床应用管理工作的通知》,要求各地要严格落实《医疗机构管理条例》、《处方管理办法》、《医疗机构药事管理规定》、《抗菌药物临床应用管理办法》、《医院处方点评管理规范(试行)》等法规规定,加强抗菌药物管理。各医疗机构要落实抗菌药物管理责任,健全抗菌药物管理工作机构,明确工作职责,完善工作制度,细化工作流程,对抗菌药物品种、品规的遴选、采购、处方、调剂、临床应用和评价等各个环节进行全过程管理与监控。鼓励各地借鉴“负面清单”管理方式,创新模式,持续提高抗菌药物临床应用管理水平。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。