参考观研天下发布《2018年中国仿制药行业分析报告-市场深度分析与投资前景预测》
1、强制力度大,企业积极备战本次政策强制力度大,289目录中的品种必须在2018年底前完成,否则将被注销文号无法生产。招标方面,通过3家以上企业的品种将不再采购未通过企业的产品,另外医保政策也将向通过的品种倾斜。企业层面也非常重视,由于采用赛跑制,非289目录品种备案数1027项,占比达到47%部分领先的企业成立一致性评价研究中心和QA部门保证一致性评价工作的顺利实施。
2、考虑成本和质量,大量批文将被放弃
目前做仿制药一致性评价试验的费用已超过500万/个,考虑到成本因素年净利润一般在100万以上的产品企业才考虑做;同时由于289目录中的品种都是在2007年以前获批的,与现在的试验标准比较还是有较大的差距,有不通过试验的风险。
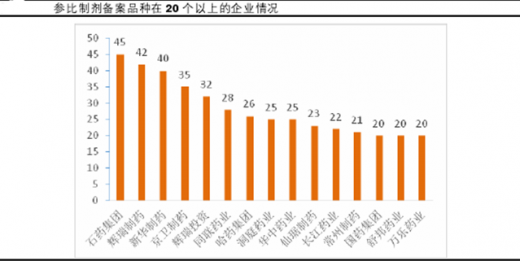
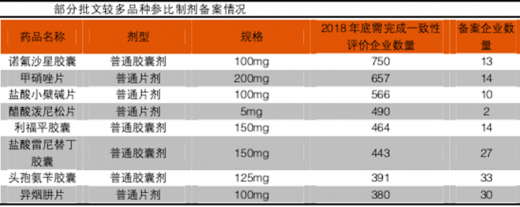
中检院公布的备案数据来看,须参评批文数17740个,备案数1162个,占比6.6%;须参评企业2038家,备案企业数424家,占比20.8%;拥有批文数过500的企业,大部分备案不及10%。对于批文数量靠前的品种,其备案企业数量也远未达到10%。随着大量生产企业的退出,行业集中度将进一步提升。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。