医疗器械行业属于国家重点管理的行业,其主管部门为国家食药监局,中国医疗器械行业协会是行业的自律管理组织。公司所处行业受国家食药监局医疗器械监管司监管,同时由中国医疗器械行业协会及其下属的医用高分子制品分会进行自律管理。
2、行业监管体制
本行业主要根据国家制定的《医疗器械监督管理条例》监管。2014 年2 月12 日国务院对《医疗器械监督管理条例》进行了修订,并已于2014 年6 月1 日正式实施,根据该条例国家对医疗器械按照风险程度实行分类管理:第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
参考观研天下发布《2018年中国医疗器械行业分析报告-市场运营态势与发展前景研究》
国家食品药品监督管理总局负责制定医疗器械的分类规则和分类目录,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。
我国对医疗器械实行分类注册与备案管理制度:第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府食品药品监督管理部门提交备案资料。申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。申请第三类医疗器械产品注册册申请人应当向国家食品药品监督管理总局提交注册申请资料。已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生非实质性变化,不影响该医疗器械安全、有效的,应当将变化情况向原注册部门备案。医疗器械生产许可证有效期为5 年。有效期届满需要延续的,依照有关行政许可的法律规定办理延续手续。
依据《医疗器械生产质量管理规范》(2014 年第64 号)、《医疗器械生产质量管理规范无菌医疗器械实施细则和检查评定标准(试行)》及《医疗器械注册管理办法》(国家食品药品监督管理总局令第4 号)要求,我国医疗器械生产企业申请医疗器械首次注册和延续注册申请过程中,会存在应国家食品药品监督管理总局技术审评机构要求进行质量管理体系核查的可能。
3、行业主要监管法律法规
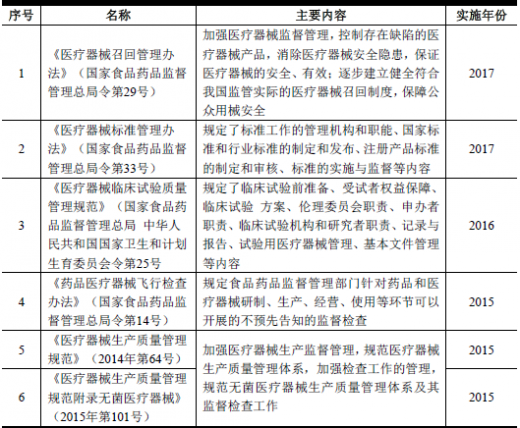

(2)与公司产品相关的国家行业标准


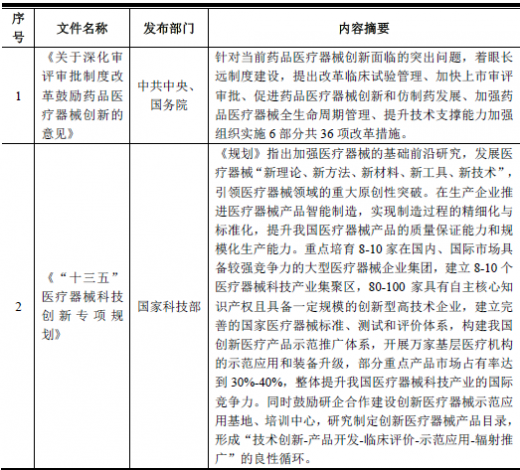
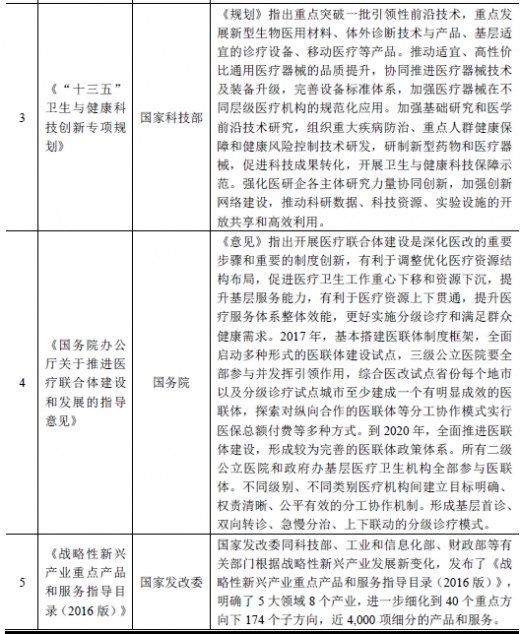
4、行业主要政策
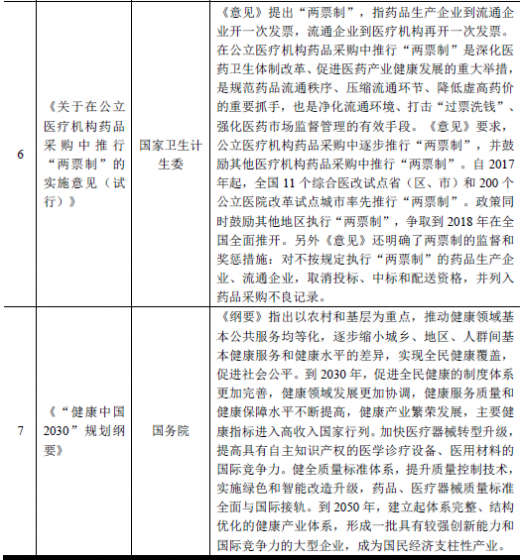
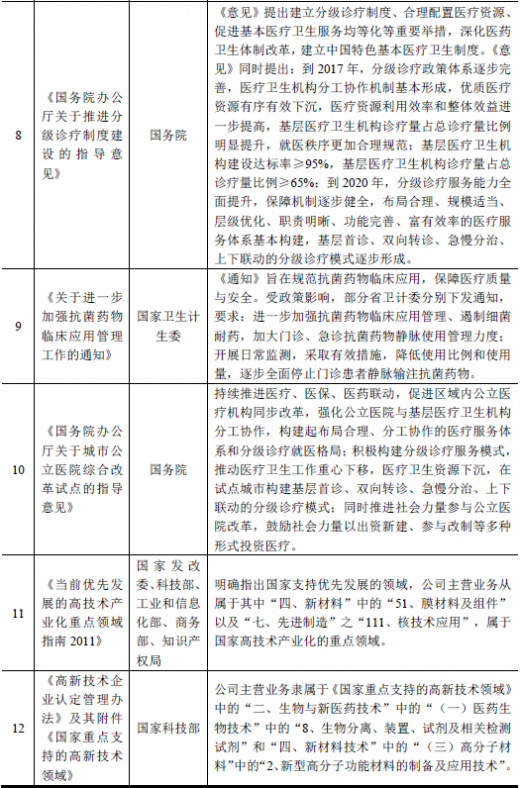

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。