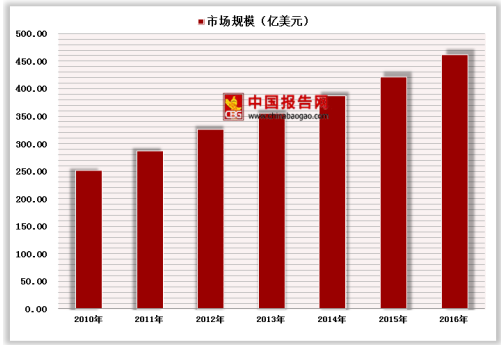
我国疫苗主要分一类疫苗和二类疫苗,一类是指政府免费向公民提供,二类是指公民自费、自愿受种的疫苗。国内主导一类疫苗市场,但呈现逐年下降趋势。中国二类疫苗市场日益成熟,二类疫苗较2017年第一季度批发签量有所上升。2017年第一季度疫苗批签发量为9864万支/瓶/粒,2018年第一季度疫苗批签发量为9232万支/瓶/粒,同比下降6.41%。2017年第一季度二类疫苗批发签量为3914万支/瓶/粒,同比上升2.39%。2017年第一季度一类疫苗批发签量为5951万支/瓶/粒,2018年第一季度一类疫苗批发签量为4520万支/瓶/粒,同比下降24.05%,主要由于卡介苗、麻风腮联苗、甲肝疫苗与10ug乙肝疫苗批发签量下降所导致。

参考观研天下发布《2018年中国疫苗行业分析报告-市场运营态势与发展趋势研究》
《征求意见稿》共十一章,分别为:总则、疫苗研制和上市许可、疫苗生产和批签发、上市后研究和管理、疫苗流通、预防接种、异常反应监测与补偿、保障措施、监督管理、法律责任和附则。重点是结合疫苗研制、生产、流通、预防接种的特点,对疫苗监管的特殊要求作出具体规定:
1过期疫苗要隔离存放,并标注“过期”警示标志。过期疫苗由县级疾病预防控制机构统一登记回收。
2国务院药品监督管理部门负责全国疫苗安全监督管理,县级以上地方人民政府对本行政区域的疫苗安全监督管理工作负责。
3上市销售的疫苗存在质量问题,召回不力的责令限期改正;逾期不改正的,处以100万元以下罚款。
4因疫苗质量问题造成受种者死亡或者健康严重损害的,受种者有权请求相应的惩罚性赔偿。
5建立全国电子追溯协同平台,整合生产、流通、使用等全过程追溯信息,实现疫苗质量安全可追溯。
现将国家药品监督管理局商国家卫生健康委员会起草的《中华人民共和国疫苗管理法(征求意见稿)》及其说明公布。公众可通过以下途径和方式提出意见建议:
一、将意见和建议发送电子邮件至:FGS@saic.gov.cn
二、将意见和建议邮寄至:北京市西城区三里河东路8号(邮编100820)国家市场监督管理总局法规司,并在信封上注明“《中华人民共和国疫苗管理法(征求意见稿)》反馈意见”字样。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。