| 时间 |
部门 |
政策名称 |
主要内容 |
| 2014.2 |
国家药品监督管理局 |
《创新医疗器械特别审批程序》 (试行) |
为鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,建立创新医疗器械特别审批程序 |
| 2015.5 |
国务院 |
《中国制造2025》 |
将生物医药及高性能医疗器械列入十大重点领域,进一步提高创新能力 |
| 2015.8 |
国务院 |
《关于改革药品医疗器械审评审批制度的意见》 |
鼓励医疗器械研发创新,优先审批拥有产品核心技术发明专利、具有重大临床价值的创新医疗器械注册申请。 |
| 2016.10 |
国家食品药品监督管理局 |
《医疗器械优先审批程序》 |
将符合国家重大科技专项、临床急需及罕见病用医疗器械等产品纳入优先审批通道。 |
| 2016.11 |
国务院 |
《“十三五”国家战略性新兴产业发展规划》 |
发展高品质医学影像设备、先进放射治疗设备、高通量低成本基因测序仪等,加快组织器官修复和替代材料及植介入医疗器械产品创新和产业化。 |
| 2016.12 |
国家发改委 |
《“十三五”深化医药卫生体制改革规划》 |
规划提出要通过市场倒逼和产业政策引导,推动企业提高创新和研发能力,提高产业集中度,实现药品医疗器械质量达到或接近国际先进水平。 |
| 2017.6 |
科技部 |
《“十三五”医疗器械科技创新专项规划》 |
加速医疗器械产业整体向创新驱动发展的转型,完善医疗器械研发创新链条;突破一批前沿、共性关键技术,重点开发进口依赖度高、临床需求迫切的高端、主流医疗器械。 |
| 2017.10 |
国务院 |
《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》 |
加快临床急需药品医疗器械审批,推动高新医疗器械创新研发,实行全生命周期管理。 |
| 2018.9 |
国务院 |
《深化医药卫生体制改革2018年下半年重点工作任务的通知》 |
推进医疗器械国产化,促进创新产品应用推广。 |
| 2018.11 |
国家药品监督管理局 |
《创新医疗器械特别审批程序》 (新修订) |
完善了适用情形、细化了申请流程、提升了创新审查的实效性、完善了审查方式与通知形式,并明确对创新医疗器械的许可事项变更优先办理。推进审评审批制度改革,鼓励医疗器械创新,激励产业创新高质量发展。 |
普通医疗器械注册时间大约为1-2年,但是如果进入创新医疗器械特别审批程序,最快审批时间可缩短至90个工作日(不包括补充材料和修改材料的时间),优质创新器械注册用时大幅减少。
参考观研天下发布《2019年中国医疗器械市场分析报告-市场深度调研与前景评估预测》
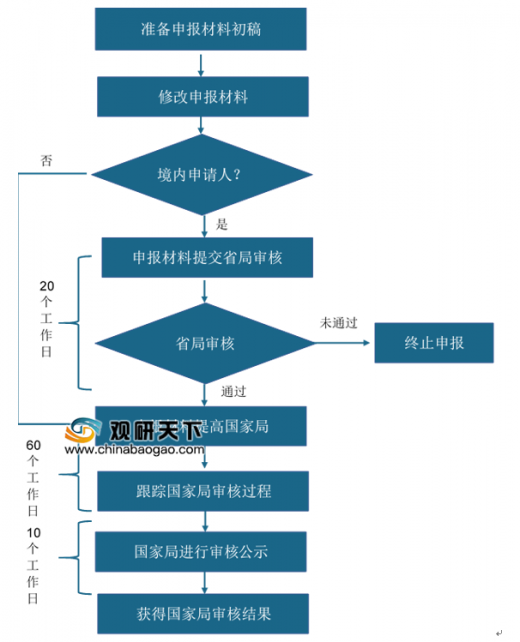
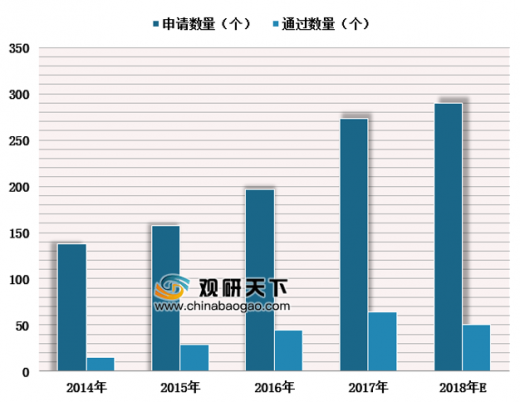
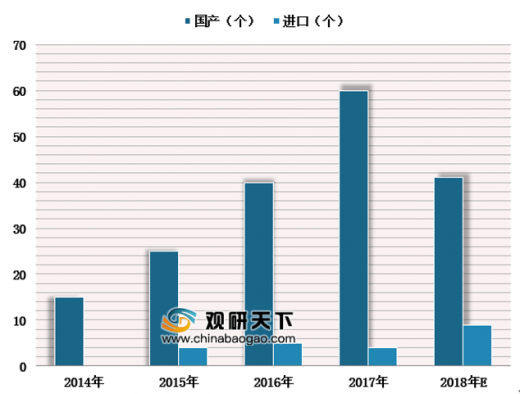
国产医疗器械厂商明显受益创新器械审批绿色通道。自2014年推出创新医疗器械特别审批程序,我国通过此绿色通道累计申请1055例,成功注册203例产品,其中国产医疗器械占比接近90%,相较进口器械,占比优势明显,有利于国产医疗器械缩短与进口品牌的差距。

【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。