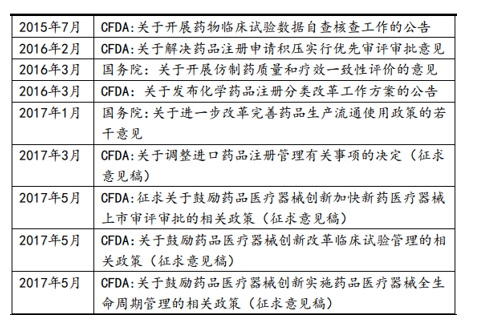
近几年,针对我国制药行业中存在的药物上市审批缓慢、创新品种缺乏、仿制药整体质量良莠不齐等现状,监管层陆续出台多项行业监管改革政策,涉及研发生产等多个环节,目的在于改变行业以往存在的一些问题,积极引导行业发展向优质和创新转型。
参考观研天下发布《2019年中国生物医药外包市场分析报告-市场现状调查与投资战略研究》
(1)清理积压&优先审评,面向未来“去库存、调结构”
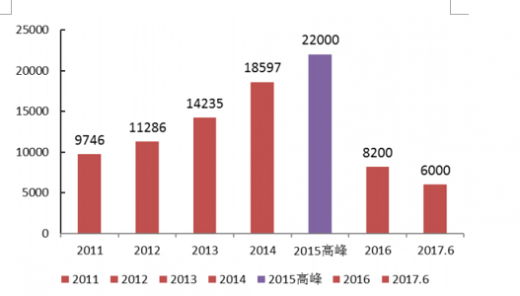
从15年开始,药审中心多措并举,包括优化审批流程、多渠道扩增审评力量等,全力解决审评任务积压。15年成为审评积压关键的转折之年:全年审批完成数首次超过申请数1300多个,积压数量由15年高峰时期2.2万个降低为年底1.7万个,同时在2016年,药审中心完成审评并呈送总局审批的注册申请共12068件,截止16年底排队等待审批数量为8200件(到17年6月仅为6000件左右)。有望于明年底之前全面实现按时限审批。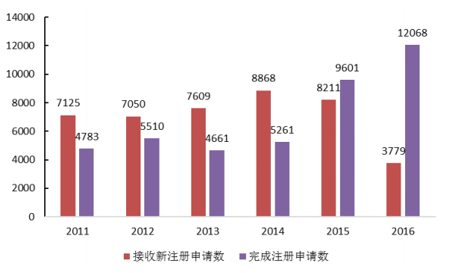
为了更好鼓励新药研发,提高药物疗效质量,更好地满足公众用药需要,并在前期征求大量意见的基础上,CFDA于16年2月正式发布了《关于解决药品注册申请积压实行优先审评审批的意见》,从意见中公布的纳入优先审评审批条件来看,具有重大创新价值且具有确切临床价值的药物更能够获得“插队”审评审批的资格。
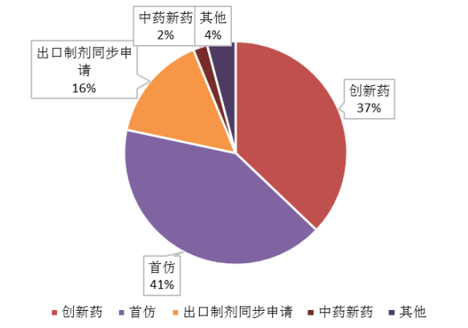
从2016年1月首批优先审评审批品种公布开始,截止到2017年6月,药审中心总计公布了20个批次优先审批品种,共166个品种。药物领域分布主要集中在儿童专用药物、抗肿瘤领域、抗病毒感染领域、罕见病和消化系统领域,表明审评资源优先聚焦于重点治疗领域和特殊群体的临床急需品种,同时一般具有新药、首仿、临床急需以及临床优势等入选理由。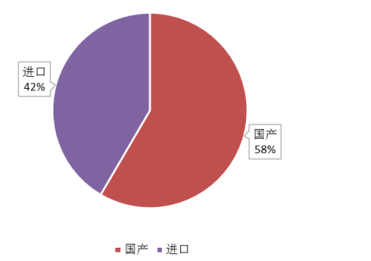
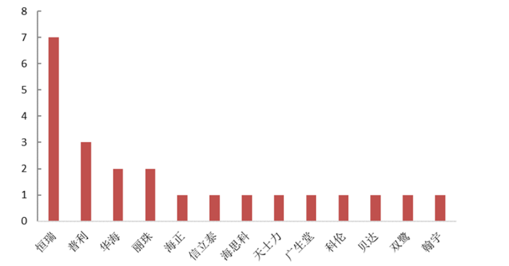
通过对已公布的优先审评品种进一步分析发现:国内企业申报情况表现出色,申报的优先审评品种占据50%以上份额(166个品种中,国内品种97个,进口品种67个),在国内申报品种里新药和首仿品种占据了绝对主导份额。其中在医药A股上市公司申报品种中,恒瑞申报品种数最多,包括1个创新药和6个仿制药,此外普利、华海、丽珠等均有2-3个品种纳入。
资料来源:CDE,观研天下数据中心整理
2、一致性评价:实际困难逐渐解决,进展加速推进
仿制药一致性评价工作的要求最早始于2013年2月份,国家监管部门发布了《仿制药质量一致性评价工作方案》,但由于未明确任务期限、相应考核机制以及其他种种因素,一致性评价工作陷入了实质性的停滞。2016年3月份,国务院正式发布了《关于开展仿制药质量和疗效一致性评价的意见》,一致性评价工作获得实质性启动。
本次一致性评价的具体工作目标是2007年10月之前上市的289个化药口服固体制剂仿制药需在2018年底之前完成一致性评价。据统计,本次一致性评价涉及的仿制药有289个品种,药品批文有1.7万多个,涉及医药企业1900家左右。在这批仿制药品种中,有17个品种拥有的批文数超过400个,拥有批文数在100-300间的品种就有28个。通过本次一致性评价,此部分仿制药市场竞争格局将极大优化,率先通过一致性评价企业将获得更大市场份额。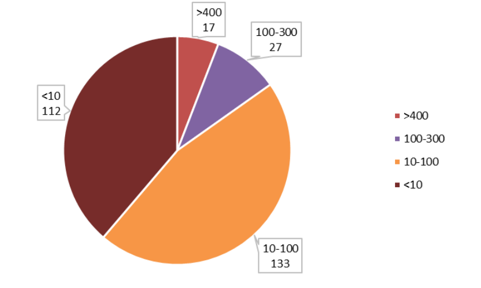

今年以来,监管层为了推进一致性评价的相关工作,出台了一系列指导意见和指导原则,涉及到一致性评价工作的诸多方面,其中包括一致性评价分类指导意见和一致性评价研制现场核查指导原则等重要指导文件。
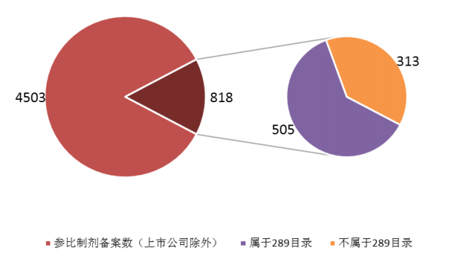
目前企业参比制剂申报备案积极,截止17年5月,参比制剂备案总数达到5300多个,其中属于本次一致性评价289品种范围内的备案数2800多个,其中有相当一部分备案品种不属于本次一致性评价范围内品种,这一现象在上市公司中表现尤为明显:在已备案项目中,上市公司的备案品种为818个,上药、石药、复星等医药龙头企业备案数排名靠前。其中非289品种的备案数已达到505个,表明很多企业为了抢占未来市场先机,已将一致性评价目标范围拓展到本次289品种以外的相关仿制药品种中。预计未来国内的仿制药市场将以本次一致性评价工作为开端,经历格局重洗后,综合研发实力较强、品种布局丰富的优质企业将获得更大市场份额。
针对一致性评价工作在推进过程中遇见的参比制剂目录公布迟缓、临床试验机构不足以及BE资源短缺等问题,监管层开展了针对性的工作,相关问题正逐渐解决。以备案品种的参比制剂目录为例:相比于仿制药品种的备案情况,相关参比制剂目录公布进展相对迟缓,由于这是开展一致性评价工作的关键步骤,CFDA在今年3月中旬起,已陆续公布了6批210个品种的参比制剂目录。预计有望在下半年已备案品种的参比制剂目录将陆续公布,从而保证相关一致性评价工作的稳步推进。


【版权提示】观研报告网倡导尊重与保护知识产权。未经许可,任何人不得复制、转载、或以其他方式使用本网站的内容。如发现本站文章存在版权问题,烦请提供版权疑问、身份证明、版权证明、联系方式等发邮件至kf@chinabaogao.com,我们将及时沟通与处理。